Maak Kennis Met Kennis En Blijf Bij Kennis.
Denkthema 33. Moleculair en atomair.
De hoofdverbinding tussen atomen (zoals tussen atm. en atm'.; figuur a.) tot
een molecuul, moleculaire binding (mol.), wordt gelegd in s-veldbotsingen
vb, vb') tussen s-velden (v/v/. . . ) van neutronmassa's (nm, nm') in die
atomen.
Wat voor een atomaire samengesteldheid van een eerste, althans ook
specifiek belang is, namelijk de hoofdligger, met daarin centraal de
protonmassa, ten behoeve van een rudimentaire/basale aanleg voor een
atoom, dat is/zijn de oerzuil(en)
voor een moleculair b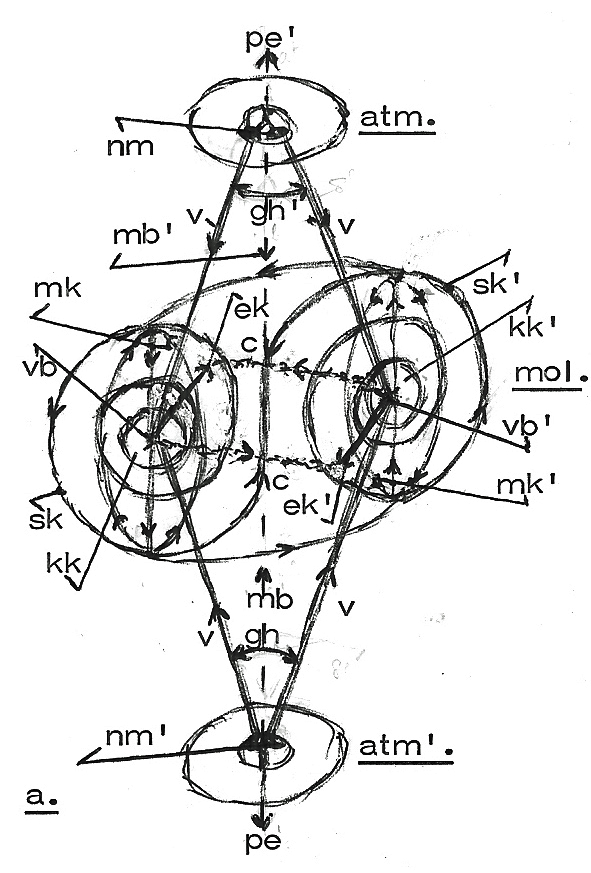 estaan.
estaan.
Dat wil zeggen, de oerzuil, wat
betreft het atoom met daarin dan
als (con)centraal de neutronmassa,
is voor ook de atomaire
samengesteldheid van een tweede,
groot belang - waarbij de
neutronmassa's, de
neutron(samen)gesteldheid, ook
nog weer worden/wordt beïnvloed/
bijgesteld door de desbetreffende
protonmassa (als "de hand door
de pols"; zie vorig denkthema) -
maar in de moleculaire binding zijn
de oerzuilen, de daarin intern
inkolkende en de daaruit extern
uitkolkende unobaden, aangebracht
in de s-veldbotsingen tussen
s-velden van eerstens de
desbetreffende neutronmassa's,
van een eerste moleculaire zetting/
opstelling in interne/externe
verkering.
In het moleculaire verband zelf, op
zich, is geen enkel massadeeltje -
geen neutronmassa, geen
protonmassa, geen electronmassa
- direct aanwezig; maar bestaat deze
verbinding volop uit reëel krachtig decentrerende spreikrachten (sk, sk')
extern de desbetreffende oerzuilen en uit oerkrachtig centrerende
kernkrachten (kk, kk') intern de desbetreffende oerzuilen.
Alsook, bestaan in deze molecuulverbanden aanbrengende s-veldbotsingen,
met hun unobaden, van een zozeer solitaire signatuur, rijkelijk menige
electrische krachten (ek, ek') en magnetische krachten (mk, mk').
Waarbij hierbij nog het meest eenvoudig moleculair verband - zeg dat van
een waterstofmolecuul, zoals met figuur a. voorgesteld - wordt aangegeven.
Het zijn doorgaans eerstens de spreikrachten, der moleculaire unobaden, die
al wijderom uittrekkend/uitcirkelend met elkaar in contact/botsing (c - c) komen
en - onder hier nog niet nader vermelde invloeden/inwerkingen - meer of
minder sterk, naar meer of minder frontale botsingen, het molecuulverband
althans vollediger aanbrengen.
Spreikrachten, die de moleculaire unobaden - dit is de desbetreffende
s-veldbotsingen (vb en vb') en daarmede de desbetreffende atomen (atm en
atm') - aaneensluiten/binden (tot) in een moleculaire binding.
Maar ook de oerkrachtige kernkrachten - met daarin de electrische
krachten en met daarmede de magnetische krachten - dier moleculaire
unobaden werken dan al meer mede aan de moleculaire binding.
Hoe meer de spreikrachten elkaar naderen en binden tot een al hechtere
moleculaire binding, hoe meer de desbetreffende electrische en magnetische
krachten daarbij elkaar naderen ter electrische aantrekking en magnetische
aantrekking ter bevordering/versteviging dier moleculaire binding.
Deze krachten besluiten derhalve, zeg maar, de moleculaire sluiting/binding
door eerstens al die spreikrachten aangebracht.
Maar er is meer.
Zoals reeds in denkthema 32 aan de hand van figuur e. uiteengezet, trekken
de s-velden van een neutronmassa onder een zekere/gemiddelde hoek
(gh/gh') uit ter s-veldbotsing (vb, vb').
Een protonmassa, met een van haar s-velden in s-veldbotsing verbonden
aan de andere twee s-velden van de desbetreffende neutronmassa - als
zoals reeds gezegd "de pols aan de hand" - hanteert, zeg maar, het viertal
s-velden van die neutronmassa als een "schaar".
Naargelang de bindingspositie van zo'n protonmassa hierbij, in een
enkelvoudig atoom, in een meervoudig atoom, is deze "schaar" meer open
of meer dicht - danwel, is de desbetreffende gemiddelde hoek (gh of gh')
groter of/respectievelijk kleiner - en scharen de desbetreffende
spreikrachten(/enzovoort; sk en sk') zich minder of/respectievelijk meer
bijeen ter moleculaire binding.
Zodoende, onder andere, gaan de unobaden dier s-veldbotsingen (vb en
vb') niet weldra in elkaar op, in de moleculaire binding, maar nemen zij
daarbij elk, spreikrachtig/kernkrachtig, hun zekere plaats/positie in.
Iets dergelijks valt hierbij ook te vermelden van de desbetreffende atomen
onder elkaar.
Elk unobad bestaat uit twee hoofdkrachten; namelijk de reële spreikracht
met haaks daarop de oerkrachtige kernkracht - zoals "gespreide armen
haaks staan op pal staande benen".
Nemen de uittrekkende/uitkolkende spreikrachten, als diverse paren
"gespreide armen", in enige "omhelzing/verstrengeling" van/in elkaar zozeer
deel aan het bestaan, daarentegen onttrekken de intrekkende/inkolkende
kernkrachten, in hun loop/afgang tot in niet-bestaan/oerniets, zich (in eerste
instantie) daaraan - als in een daarin tegenhoudende/terugtrekkende
instelling/werking "der benen".
Aldus, neemt het ene s-veld van een protonmassa, in haar verankering om
en nabij de desbetreffende neutronmassa, al "schaarhanterend" deel aan
zekere spreikrachten (sk en sk') ter moleculaire binding uitwendig het
desbetreffend atoom, inwendig dit atoom bindt deze protonmassa zich
(onder andere) electrisch aan de desbetreffende electronmassa (zie ook
denkthema 32, aan de hand van figuur b.) "als de poort naar het
niet-bestaan/oerniets" - terwijl ook het andere s-veld van die protonmassa
daaraan toedoet.
Kortom, in deze ook zozeer atomair terughoudende/weerstaande opstelling/
weerwerking van de protonmassa-electronmassa (pe-pe') in betrekking tot
de moleculaire binding (mb-mb'), gaan de desbetreffende atomen niet op
in enige moleculaire binding zelf, maar "houden zij afstand daarvan en van
elkaar".
Aldus is de protonmassa, met haar s-velden, wel als de hoofdspil aan te
merken in zowel hier de segmentaire moleculaire (samen)gesteldheid/werking
alswel in de rudimentaire atomaire (samen)gesteldheid/werking als het
ontmoetingscentrum in eerstens al de hoofdligger aldaar.
Maar intussen stelt onder (onder andere) dit een en ander de moleculaire
binding zelf, danwel het contact (c - c) tussen de desbetreffende
spreikrachten, zich in.
Dit valt voor te stellen met een in (externe) verkering wat/meer "scharnierende
scharnier"/"schelpdier"; met die spreikrachten als de (eventueel) wat ovale
scharnierbladen en het contact als de wat beknopte/puntige of wat uitgerekte/
lineaire scharnierpen.
Onder andere ook al: hoe meer de scharnierbladen/spreikrachten zelf tevens
wat/meer tegen elkaar indraaien, hoe heviger allerlei botsing daartussenin,
hoe meer de geplaatste scharnierbladen van dat scharnier zich al inkerend
zullen dichten tot een al heviger/krachtiger saamgetrokken, standhoudende,
zeg "stevige harde plaat".
Daarentegen, in onder andere meer met elkaar meedraaiende spreikrachten/
scharnierbladen, kan het scharnier zich meer openen tot een minder krachtig
samenstel der scharnierbladen - als dan zeg maar meer kwetsbaar/"broos"
of bijvoorbeeld ook wel meer meegaand/flexibel/aanpasbaar.
Acht men de verstandelijke opvatting van het een en ander, zoals beschreven
in denkthema 13 aan de hand van figuur c., ook hier van toepassing, als
geldend voor ook wat verstandelijk wordt opgevat, dan bestaat
dienovereenkomstig ook een moleculair(e) binding/scharnier uit "schijfjes"/
scharnierbladen in onderling(e) contact/betrekking.
Als feitelijk een materiëel bestaan, waaraan ook reeds het technische, de
scharnierpen, niet ontbreekt.
In werkelijkheid ligt hierin de materiële
eigenheid van dat 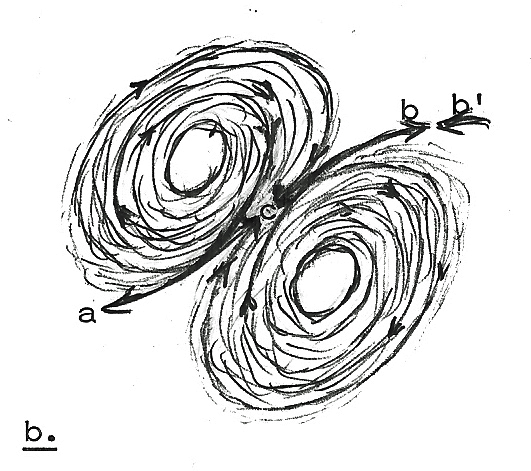 molecuul besloten.
molecuul besloten.
Zekere moleculaire eigenschappen,
van meer hard, meer flexibel, enzovoort.
En naarmate een moleculaire binding
complexer is, als bijvoorbeeld
bestaande uit meer op elkaar
betrokken scharnieren, wegens
bijdragen daaraan uit meerdere, ook
complexere atomen, hoe meer bijzonder
zijn eigenschappen.
En voor de onderlinge betrekking/
binding van moleculaire scharnieren,
zijn vooral de desbetreffende
scharnierpennen ingesteld.
Zo'n scharnierpen (a - c - b; figuur b.) is in een ontmoetingsrelatieve-
scheidingsrelatieve (immobiele) betrekking tussen wat/meer tegen elkaar in
draaiende (demobiele) scharnierbladen/spreikrachten (sk en sk').
En niet alleen kunnen de betrekkingen constructief op elkaar betrokken
raken en (in zeg verkeringsevenwicht) zijn - zoals b met b' van een ander
spreikrachtenkoppel.
Maar ook geven deze bet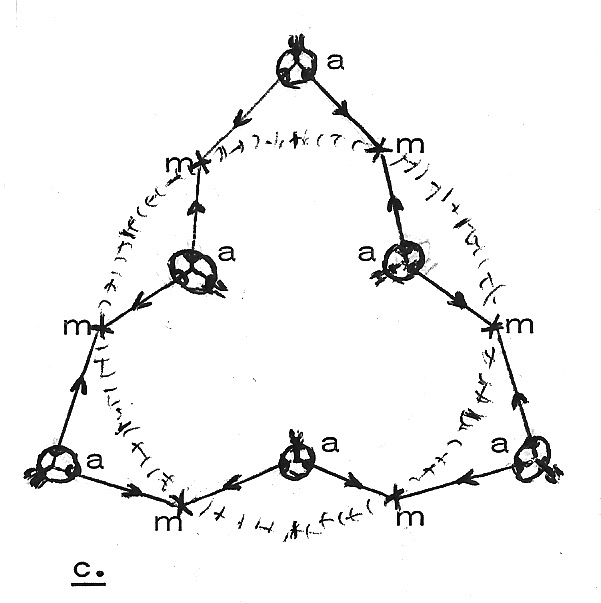 rekkingen
rekkingen
tussen scharnierpennen het
desbetreffend molecuul weer een
eigenschap, die van bijvoorbeeld
een geleidende eigenheid, waar b
groter is dan a → enzovoort.
In figuur a. hebben twee
allereenvoudigste atomen,
waterstofatomen, zich verbonden
tot een molecuul, een
waterstofmolecuul.
Voor deze eenvoudige atomen is
hiermede een moleculair verband
geschetst als van een meest
evenwichtige, standhoudende
samenstelling - zo voor deze
atomen de segmentaire
verbindingen worden begunstigd
boven eerstens een rudimentaire
band door allerlei eigenheid en
omstandigheid, zoals in het elkaar benaderen en nabij staan onder zekere
(s-)veldbotsingshoeken.
Maar in werkelijkheid zijn er nog menige andere moleculaire
verbindingspatronen (zoals er een in figuur c. is geschetst, van meerdere
atomen, a/a/ . . . , in meerdere moleculaire bindingen, m/m/ . . .) tussen
juist ook meer complexe atomen.
Doch wat zich slechts segmentair moleculair voltrekt tussen atomen, kan
zich tussen atomen ook standhoudend atomair voltrekken met zeg
segmentaire verbanden in een rudimentaire houder - en waarvan nu
vervolgens wat nader.
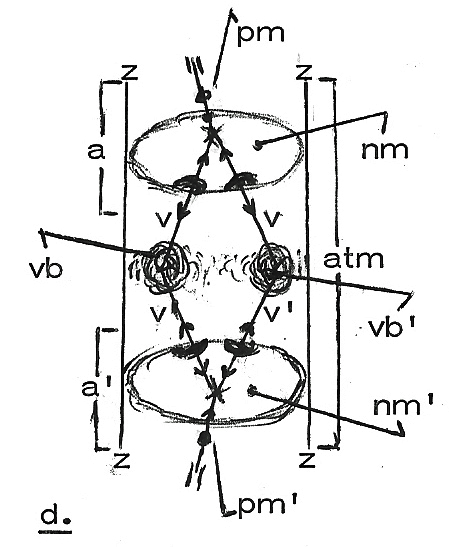
Binden twee
allereenvoudigste atomen
(a en a'; figuur d.), als twee waterstof
atomen, zich in
segmentair verband
samen tot een
nieuw/complex atoom
(atm), het
heliumatoom, dan vindt er,
allereenvoudigst
aangegeven, een
omslag plaats van een
moleculaire
atomair-externe
verbinding tussen
(minimaal) twee atomen
in een
complex-atomaire
atomair-interne
verbinding tussen die
twee atomen.
De desbetreffende
s-velden (v, v en
v', v') der beide
neutronmassa's
(nm en nm') treffen
elkaar ter
s-veldbotsingen (vb en
vb') dan niet
aan buiten die atomen,
maar binnen
die atomen - in oerkrachtig (binnen) de oerzuil (z - z - z - z); danwel
doorgaans in het kruispunt der beide atomaire oerzuilen (want reeds een
allereenvoudigst atoom heeft een eigen oerzuil).
De s-veldbotsingen vinden plaats op een reeds oerkrachtig inkolkende
plaats; zodat onder deze inkerende/centrerende invloed de unobaden
van die s-veldbotsingen van maar een weinig uitkolkende reële
spreikracht zijn - en deze unobaden veelal nauwelijks of geen direct
contact hebben met elkaar.
Hier zeg maar geen "scharnierbladen die om een gezamenlijke
scharnierpen scharnieren".
Maar daarentegen oerkrachtig "wortelende" unobladen, die tevens in een
in zichzelf zozeer oerkrachtig "wortelende" oerzuil zijn terecht gekomen -
waarmede zo'n complex-atoom (zijn deelatomen) zich standvastig bindt(/
binden) in een hechte samengesteldheid.
En in dit zeg hechte gebint zijn ook de desbetreffende protonmassa's (pm
en pm') met hun s-velden hecht oerkrachtig verankerd; terwijl anderzijds/
buitenzijds van de protonmassa's aan hun s-velden de electronmassa's
met hun s-velden middelpuntzoekend-middelpuntvliedend rondtrekken.
Intussen zijn in zo'n complex-atoom alle s-velden dier neutronmassa's
daarin/daartoe gebonden; zodat geen enkel s-veld van een neutronmassa
dan nog over is voor het aangaan van een moleculaire binding buiten dit
complex-atoom.
Dit zogenaamde heliumatoom, als het product van twee waterstofatomen,
is zo als "afgerond"; als zo niet geschikt om alsnog deel uit te maken van
een molecuul, van dus een moleculaire binding.
Tot zover dan de segmentaire samengesteldheid van/in een complex-atoom.
Maar heeft een complex-atoom tevens (eerstens) een rudimentaire
samenstelling - waarbij, als in haar schoot, de segmentaire samenstelling
zich voltrekt - en daarvan nu wat nader.
Met deze
segmentaire atomaire binding
zijn zowat alle
s-velden der desbetreffende
massa's -
de twee neutronmassa's, de
twee
protonmassa's en de twee
electronmassa's
- ondergebracht.
Alle acht
s-velden van de twee
neutronmassa's,
alle vier s-velden van de
twee
protonmassa's en twee van de vier
s-velden der
twee electronmassa's liggen
als
verwerkt/verbonden in de segmentaire
constructie van
dat complex-atoom; slechts
de twee
resterende s-velden dier twee
electronmassa's
zwiepen nog
(middelpuntvliedend) rond in/ter allerlei
contact buitenaf.
Rest daarbij nog
het resultaat te bezien van
de
c-veldbotsingen/unobaden dier beide
deelatomen, die
althans atomair eerstens
zelfs de
rudimentaire samengesteldheid/
band van zowel
die twee deelatomen elk
alswel van het complex-atoom bezorgen/verzorgen.
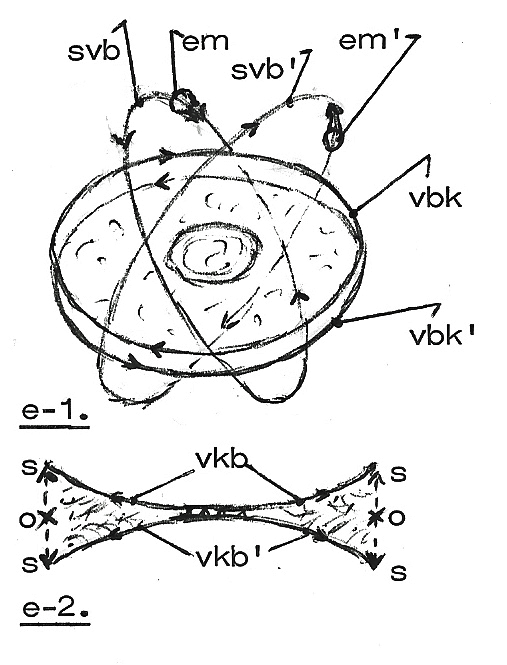
Voorzover enkele c-veldbotsingen als unobaden zijn geïntegreerd in unodeeltjes
tot die twee deelatomen, hebben ook de twee desbetreffende, krachtig
uitkolkende verbindingskrachten/"schijven" (vbk, vbk'; figuur e-1.; zie van de
verbindingskrachten ook denkthema 32, aan de hand van figuur b.) al elkaar
wat/meer ontmoetend en (oer)krachtig bindend contact met elkaar.
Evenwel niet als twee "scharnierbladen, scharnierend om een gezamenlijke
scharnierpen", maar als twee wat/meer/zeer tegen elkaar geplaatste-, "op
elkaar gestapelde" "schijven"; want de segmentaire bindingen in het
oerkrachtig (oerzuil)centrum (oz) doen zich tevens gelden en trekken de
centra dier "schijven" al nader en hechter tot/aan elkaar.
Twee wat/meer/zeer tegen elkaar in draaiende verbindingskrachten/"schijven"
zijn in hun onderling (oer)krachtig bindend contact de rudimentaire band van
het complex-atoom.
En als meer haaks daarop wentelen daaromheen veelal de electronmassa's
(em, em') rond, tegen de draaiingen der beide sub-verbindingskrachten (svb,
svb'; zie van deze beide krachten ook denkthema 32, aan de hand van figuur
b.) in trekkend.
Hoewel, ter onderlinge binding, wat/meer tegen elkaar in draaiend, bestaan
deze verbindingskrachten, waarin dus ook opgaand de decentrerende
spreikrachten der geïntegreerde unobaden, zelf wel, reëel, uit vooral
uitkolkende/uitkerende krachten - die al uitgaand elkaar (oer)kracht
verwekkend bindend ontmoeten.
Dat wil zeggen elkaar deels ontmoeten; anderdeels trekken de twee
verbindingskrachten alsnog decentrerend wat/meer van elkaar uit/weg naar
elders - als zo zeg "twee holle ronde roterende deksels met de bolle kanten
tegen elkaar (figuur c-2.).
Onder nog allerlei invloed, naar allerlei gesteldheid, zijn deze wat/meer met
elkaar verbonden verbindingskrachten (vkb, vkb') onder elkaar decentraal als
aan de (buiten)randen wat/meer scheidingsrelatief (s - s, s - s) open of wat/
meer ontmoetingsrelatief (o, o) gesloten.
En hiermede komen dan weer rudimentair, in een meervoudig complex-atoom,
andere (ver)bindingen tot st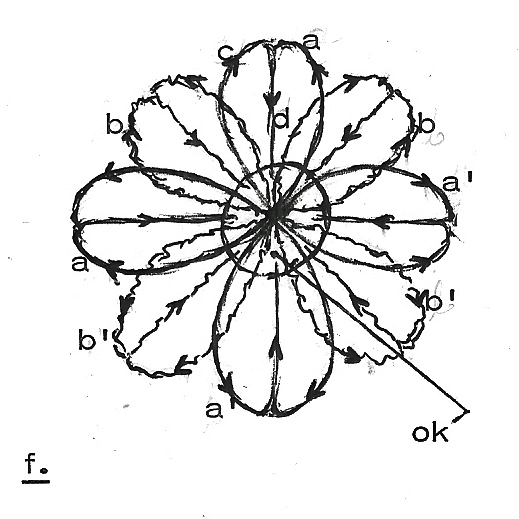 and
and
(zoals ook aangegeven met figuur f.).
Een complex-atoom van al een
achttal deelatomen in enige
complex-atoomschaal verschaft reeds
een complex verbindingspatroon.
Eerstens dan weer (gesteld) twee
aan twee rudimentair met elkaar
verbonden deelatomen (zoals a - a
met a' - a', b - b met b' - b', enzovoort);
vier stellen, van stel naast stel onder
45 hoekgraden.
Waarbij al uitgaand/wijkend een
stelpartner weer contact maakt met een
stelpartner van een ander stel (zoals
a met c) - in een weer oerkrachtig
gesteld-, een op de oerkracht (ok)
gesteld verbindingscontact (zoals d).
Maar intussen zijn er ook meervoudige complex-atomen met een extra
neutronmassa, of waaraan een electronmassa ontbreekt - en nog andere
complex-atoomvariaties.
Het is denkbaar dat een deelatoom (zoals A.; figuur g.) in/van een complex-atoom
als zo terloops deelneemt aan een segmentaire moleculaire binding (mb) met
weer een ander atoom of met een deelatoom van weer een ander complex-atoom.
Maar veelal maakt een
com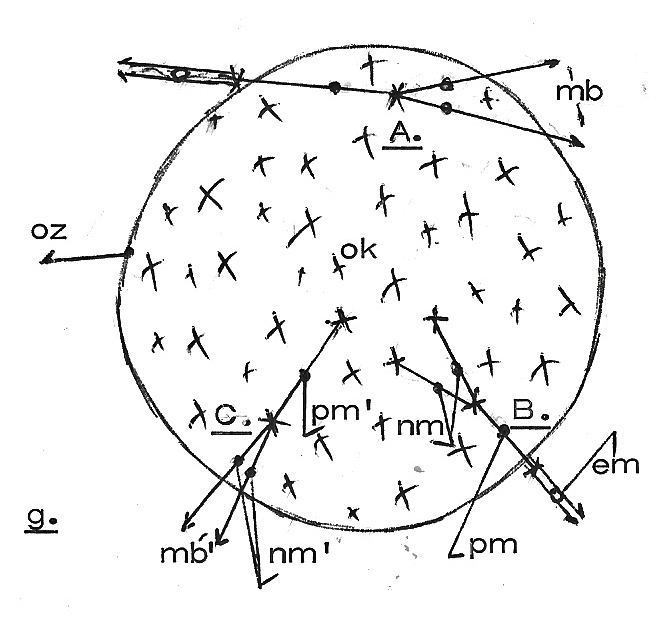 pleet
pleet
deelatoom (zoals B.) - met een
neutronmassa (nm), een
protonmassa (pm) en
een
electronmassa (em)
- in vooral
intern de oerkrachtige
(ok) oerzuil
(oz) deel uit van een
segmentaire
atomaire binding, ter
zo een
meervoudiger
complexiteit van
een/dat complex-atoom
in een
standhoudende
samengesteldheid
daarvan.
Evenwel, ontbreekt aan
een
deelatoom (zoals C.) de
electronmassa, dan
maakt dit het
overige stel massa's
- van
neutronmassa (nm') en
protonmassa (pm')
- van dat
deelatoom een
segmentaire
moleculaire binding (mb').
In het oerkrachtig centrum van dat (dan zogezegd een-waardig) complex-atoom,
is dit deelatoom dan met zowel een stel s-velden van zijn neutronmassa alswel
met beide s-velden van zijn protonmassa voldoende oerkrachtig/centraal/
centraliserend "geworteld" om tevens buitenaf/decentraal zich een moleculaire
binding te veroorloven.
Zo is het mogelijk dat één complex-atoom, zoals het zuurstofatoom (O; figuur h.;
bestaande uit zestien deelatomen), met twéé stel "(ak)koorden" een moleculaire
binding (mb) aa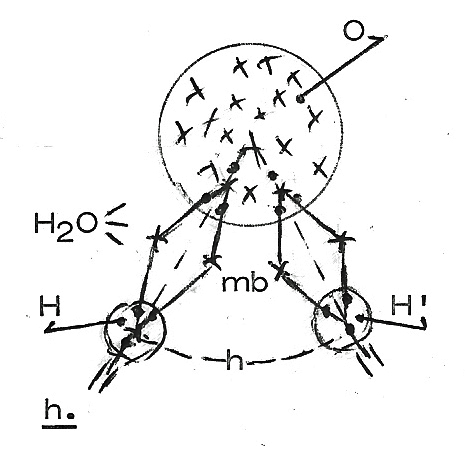 ngaat
met twee aparte
ngaat
met twee aparte
elementaire
(waterstof)atomen (H en H'), met
voor elk
waterstofatoom één stel s-velden
ter beschikking.
In dit
waterstofmolecuul (H2O) is h
dan
zogezegd twee-waardig;
en staan in een
desbetreffend
verkeringsevenwicht
van het watermolecuul
de twee
waterstofatomen onder een zekere
(s-veldenbotsings)hoek
(h) met elkaar in dus
dat
watermolecuulverband opgesteld.
Blijkt intussen het
aantal verschillende
complex-atomen nogal
beperkt te zijn - op
aarde zijn er twee en
negentig verschillende,
van en met het
waterstofatoom met een
protonmassa/enzovoort tot en met het uraniumatoom met twee en negentig
protonmassa's/enzovoort - het aantal verschillende moleculen/molecuulpatronen
is legio, nagenoeg ontelbaar.
Maar tenslotte nog een tweetal opmerkingen/details betreffende de (on)stoffelijke
wereld van complex-atomaire en moleculaire verbindingen.
Eerste opmerking.
Zoals al eerder uiteengezet, pulseert het krachtig kolkend unodeeltje tweeërlei:
diametraal al afwisselend middelpuntzoekend en middelpuntvliedend, en als
haaks daarop rondom als in het rond (zie ook denkthema 28, aan de hand van
de figuren d. en e.).
Dit is ook het geval met de unokracht, wanneer een unobad zich heeft gevoegd
in een unodeeltje.
Een krachtig kolkende en ook verwordende unokracht, aldoor aangevuld -
behalve uit (botsende) veldenergieën - door de daarin afgaande "smeltende"
desbetreffende massa's en het desbetreffend massaal, die aldus zowel
diametraal alswel rondom pulseert.
Het rondom pulseren overweegt wanneer de reële kracht van de unokracht
overweegt op de oerkracht; en het diametraal pulseren overweegt wanneer
de oerkracht van de unokracht overweegt op de reële kracht - terwijl in dit
laatste geval de desbetreffende massa's, zoals de protonmassa, meer apart/
particulier worden/zijn, als van collectieve deelname aan de oerkracht naar
een meer/overwegend solitair, krachtig kolkend bestaan.
Zeg een meer op/in zichzelf teruggetrokken protonmassa, die naar/in meer
solitair/centraal vooral oerkrachtig inkolkend overwegend (massa)diametraal
pulseert; en voor het overige ook nog wat/meer (reëel krachtig) rondom/
rondtollend pulseert - als de zogenaamde spin van de (proton)massa.
Maar ook dit al afwisselend ineen-uiteen (i-i - u-u; figuur i.) diametraal
pulseren van een (proton)massa (m) komt tot uiting in het weerzijds van deze
massa uitgaand s-veld (sv - sv).
Het overigens aldoor rechtuit (en met de spin mee omwentelend) uitspiralend
s-veld vertoont dan een veldpatroon van afwisselend "buiken" (b - b, b' - b')
en "knopen" (k - k, 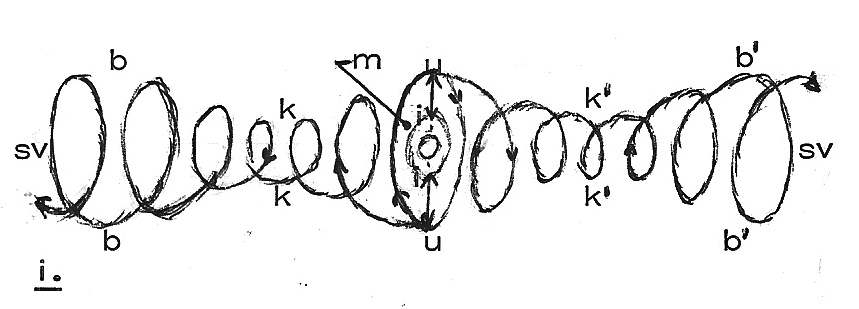
k' - k') - álsof
het
transversaal voortgolft.
Ook een s-veld
bestaat uit slechts
krachteloze "grijze"
energie, in onzijdig
bestaan.
Maar is tevens met
zijn "knopen" en
"buiken" het uitdruksel
van de desbetreffende massa die, in diametrale pulsering, meer oerkrachtig
ineen "geknoopt" van een meer electro-magnetische kracht is, en in
afwisseling daarmee meer reëel krachtig uiteen "gebuikt" van (veel) minder
electro-magnetische kracht.
En deze afwisseling in/van een diametraal pulserende massa drukt zich niet
alleen uit in elk der uitgaande s-velden; maar voorts ook in een s-veldbotsing,
in het desbetreffend unobad.
Afwisselend is zo'n unobad - bijvoorbeeld gesteld dat die s-velden in
s-veldbotsing beurtelings juist met hun "knopen" en dan weer juist met hun
"buiken" in botsing zijn - dan meer oerkrachtig ofwel kernkrachtig meer van
een electro-magnetische kracht en dan weer meer reëel krachtig ofwel
spreikrachtig (veel) minder electro-magnetisch.
En: ook zo'n unobad, van een s-veldbotsing, kan nog weer worden opgenomen
in een unodeeltje/unokracht (enzovoort).
De tweede opmerking betreft de c-velden.
Legio c-velden zijn met elkaar in c-veldbotsingen; en menig unobad daarvan
kan worden opgenomen in menig unodeeltje tot een unokrachtig
complex-atoom.
Bijvoorbeeld d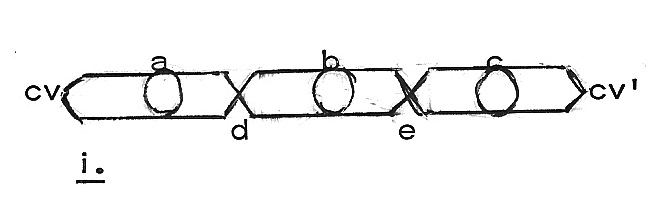 rie unodeeltjes (a, b
rie unodeeltjes (a, b
en c; figuur j.), waarvan de
c-velden met elkaar in
c-veldbotsingen zijn, en waarvan
enkele unobaden (zoals d en e) in
die drie unodeeltjes liggen gevoegd
- zodra hier die unodeeltjes
al
graviterend, zich verplaatsend, op
elkaar botsen en bij elkaar blijven - tot een (in dit voorbeeld) drie-ledig
complex-atoom.
Intussen heeft zo'n complex-atoom dan nog c-velden (cv en cv') over, om ook
daarmede alsnog deel te nemen aan een moleculaire binding.
Een altijd wel zo te noemen segmentaire moleculaire binding, want in een
moleculaire binding zelf bevindt zich geen unodeeltje, geen massa/massaal;
maar met ook c-veldbotsingen is een moleculaire binding nog weer wel van
een meer complexe samenstelling.
Ook zal veelal in een veldbotsing elk der desbetreffende velden niet totaal
daarbij betrokken zijn (zie bijvoorbeeld ook denkthema 32, figuur c-2.); zodat
ook zeg maar "c-veldrestanten" van complex-atomair menige rudimentaire
c-veldbotsing kunnen deelhebben aan een desbetreffende segmentaire
moleculaire binding.
Tenslotte nog een kleine bijzonderheid wat betreft een c-veld.
Bijvoorbeeld c-veld cv, dat nog compleet blijft uitgaan van unodeeltje a, dat
zelf nog weer unokrachtig betrokken ligt in dat complex-atoom (van a, b, c en
d en e).
Want vindt er nu in zo'n complex-atoom wat betreft unodeeltje a een
(massale) inspringing plaats van een buitenschaal naar een binnenschaal
(zie van de verspringing van een schaalpulsering denkthema 31, aan de
hand van
figuur a.), dan komt
dit ook
tot uiting in he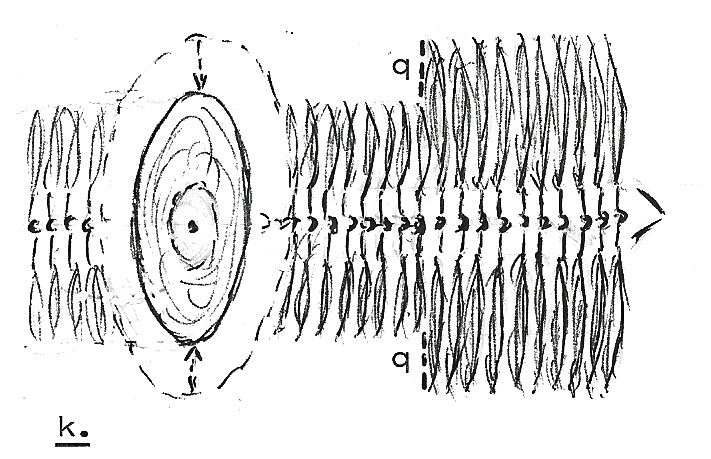 t
t
uitgaand
desbetreffend c-veld
(hier cv).
Zo'n
c-veld verandert dan ook
abrupt in
doorsnee - naar
hier een
kleinere doorsnee.
En heet
zo'n abrupt
c-velddoorsneeverval een
quant (q;
figuur k.).
Een quant
duidt dan op enige
abrupte
samenpakking van de
desbetreffende c-veldenergie.
En komt
dit ook tot uiting in een
c-veldbotsing/unobad(/unokracht)
zodra
zo'n quant aan die
c-veldbotsing deelneemt.
Bij nog weer voldoende aanwezig leven/bewustzijn, in bijvoorbeeld zo'n
unokracht/complex-atoom, wordt er dan ook wel gesproken van een lichtquant/
foton.
*
- * - * - *
 estaan.
estaan. molecuul besloten.
molecuul besloten. rekkingen
rekkingen 

 and
and  pleet
pleet  ngaat
met twee aparte
ngaat
met twee aparte 
 rie unodeeltjes (a, b
rie unodeeltjes (a, b  t
t